反应级数决定了反应速率对反应物浓度变化的敏感程度,这对于理解反应动力学行为至关重要例如,在一级反应中,反应速率正比于单一反应物的浓度,而在二级反应中,速率与反应物浓度的平方成正比通过准确测定反应级数,我们可以更精确地描述反应过程,预测反应趋势综上所述,化学反应速率之比等于化学计量数;影响反应速率的只有浓度,压强,温度,催化剂正反应和逆反应都受影响浓度越高,反应越快 压强越大,反应越快 温度越高,反应越快 有催化剂,比没催化剂反应快通常说催化剂都是指正催化剂影响化学平衡的有浓度,温度,压强根据勒夏特列原理,反应会向减弱这种反应的趋势进行例如正。
改变压强的本质是浓度的改变,这对吗压强对反应速率的影响是通过改变浓度是实现的 Cs+H2Og===COg+H2g,保持体积不变时,充入N2,使体系压强增大 此题压强的确增大了,根据克拉伯龙方程 PV=nRTR是常数,T是温度P=nRTV,容器中气体的物质的量增加会使压强增大,但由于;现行国际单位制建议 值除以反应式中的计量系数,即 这样就得到一个反应体系的速率v都有一致的确定值简单说,高中的化学反应速率是指用不同物质浓度表示的反应速率,必须指明是化学反应中的哪种物质大学的化学反应速率做了归一化,一个化学反应化学方程式只有一个反应速率参考百度百科。
3加入催化剂,增大的只是速率,但是由于正逆反应同比增大,所以不存在转化率增大的问题 二恒容恒温下,同时将混合气体浓度增大,反应会正向移动因为在此情况下,正逆反应速率都增加,但是由于正反应物有两个,反应速率增加得更快,超过了逆反应速率,所以平衡正向移动这是大学里要讲的速率定律;对于反应物来说,消耗速率就是正反应速率,生成速率就是逆反应速率而对于生成物则恰好相反因此,如果用速率来判断是否平衡,则必须注明是哪个速率只有正逆反应速率相等才能证明反应达到平衡,如当下式成立时v正H2=05v正HI=05v逆HI则可证明反应达到平衡 “正”“逆”指的是正反应。
1 固体的化学反应速率可以通过单位时间内固体反应物质量的减小或生成物质量的增加来表示2 由于固体的浓度C可以表示为C=nV=mρVM,其中ρ是密度,M是摩尔质量,这个比值是定值3 因为固体的浓度不会发生变化,所以不能像溶液那样用浓度变化来表示反应速率4 固体反应速率的单位;化学反应速率=浓度变化反应时间 我们所说的反应速率,是指某段时间内的平均反应速率,而不是即时速率 如题,如果是0秒的话,浓度变化为0,此时的反应速率就是0。
根据平衡常数K=cN2O4cNO2^2又温度不变,K不变 现在充入了NO2,平衡一定还会正向移动一下,N2O4还会变多,cN2O4增大,那么根据K不变,最终cNO2还是会增大,才能保持K可以不变 由于恒容,cNO2增大就有NO2的体积分数变大。
化学反应速率是高中哪本书里的
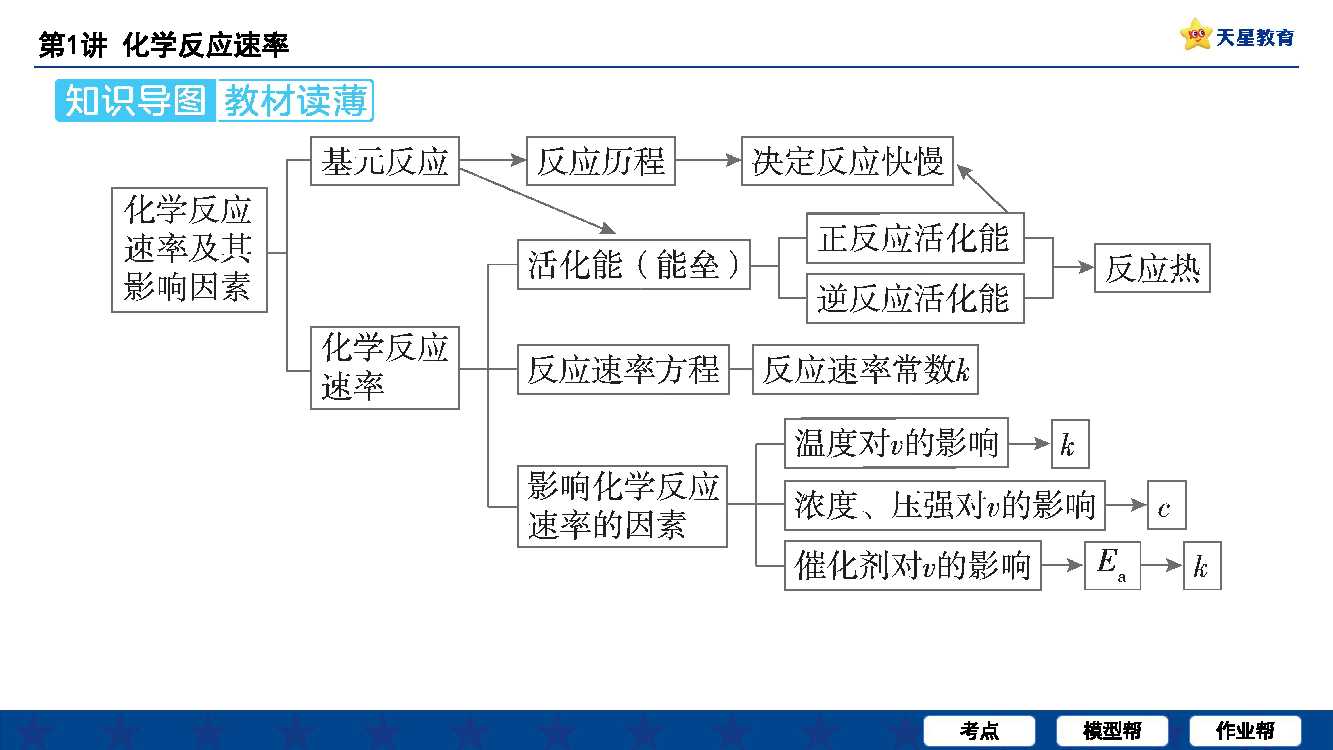
1、影响化学反应速率的因素 内因反应物本身的性质外界因素温度,浓度,压强,催化剂,光,激光,反应物颗粒大小,反应物之间的接触面积和反应物状态另外,x射线,γ射线,固体物质的表面积与反应物的接触面积,反应物的浓度也会影响化学反应速率化学键的强弱与化学反应速率的关系例如在相同条件下。
2、反应速度的比为反应物和生成物的系数比,即VA VC b慢反应如铁锈反应速率永远为正,物质系数之比一定是反应速率之比但不一定是平衡状态下物质浓度之比化学反应速率的测定和计算对于理解和控制化学过程至关重要通过上述方法和公式,可以准确地描述和预测反应速率的变化,从而优化反应条件,提高生产效率在。
3、1温度高,温度越高反应速率越快 2氧气浓度大,反应物浓度越大速率越快 3粉末状与盐酸的接触面积大,速率快颗粒越小接触面积越大 4使用催化剂加快反应速率中学阶段都是正催化剂即加快速率5高压下,单位体积内反应物的物质的量大也就是浓度大,速率快。

4、N2+3H2==2NH3 氨的速率为2 则根据系数比,氮气的速率就是1 氢气是3 2min末N2的浓度为7molL 那么N2的初始浓度就为 7+1*2=9molL 等物质的量的氮气和氢气充入一密闭容器 则氢气的起始浓度也是9molL。
5、既然是机理 那么两个反应都是基元反应 根据质量作用定律可以得到两个反应的速率方程 分别是v1=k1×cNO×cBr2v2=k2×NOBr2×NO总反应的速率大小由速控步决定,也就是慢反应 所以v=v1=k1×cNO×cBr2 因为NO Br2都是反应物 所以总速率方程和v1完全一致。
6、把所有反应物各自的速率分组速率除以它们各自的化学计量数,可以得到的一个统一的速率,这个速率用来表示整个反应更加统一直观已知各个反应物生成物的反应速率之比,等于各自的系数之比,那么上述反应的速率为vB = 03molL·minvA = 04molL·minvC = 02mol。
高中化学反应速率怎么求
NO反应速率为03mol5L30s = 0002molL·s所以,B是错的接下来通过化学计量数之比分析其他选项AvO2VNO = 54,因此vO2=00025molL·s,错误C首先需要确定H2O是否为气体如果是的话,vH2OvNO=64=32,因此vH2O=0003molL·s。
#高一# 导语进入高中后,很多新生有这样的心理落差,比自己成绩优秀的大有人在,很少有人注意到自己的存在,心理因此失衡,这是正常心理,但是应尽快进入学习状态 高一频道为正在努力学习的你整理了高一化学化学反应速率和限度教学设计,希望对你有帮助! 篇一 知识与技能 1使学生深化对化学反应的本。


发表评论